
冠心病学科交叉暨介入治疗大会
Coronary Multidisciplinary & Interventional Therapeutics
心血管急重症医学大会
Acute & Intensive Cardiovascular Care
新闻资讯

CMIT专访——肿瘤与心脏病“组团”来了,怎么办?
恶性肿瘤和心血管病是威胁人类健康的两个主要“杀手”。当“杀手”组团来袭,无论对心脏科、还是肿瘤科医生,都提出了新的挑战。面对这种威胁,需要心脏科与肿瘤科医生的强强联手,以顽抗疾病。这两个重点学科的交叉与合作,必然会引起大家的关注与侧目,也将成为健康领域的“大事件”。
本届冠心病学科交叉暨介入治疗大会(CMIT 2016)邀请到中国医学科学院肿瘤医院副主任医师刘鹏教授,与您分享他站在两个学科“交叉点”上的经验与体会。
刘鹏,中国医学科学院肿瘤医院副主任医师,经治各种常见内科肿瘤化疗,尤其是肺癌、恶性淋巴瘤治疗和高剂量化疗联合自体造血干细胞移植治疗(HDCT+APBSCT)工作;熟练掌握实体肿瘤诊断、内科治疗、常见及罕见不良反应的诊治,及胸穿、腹穿、骨穿、腰穿、锁穿、股静脉穿刺置管、B超定位下心包穿刺置管引流等各项内科临床常规操作。2005年获得GCP培训证书,2012年参加SFDA组织FIH临床研究培训,熟悉GCP规范,参与国际/国内多项新药临床研究。

访谈要点
刘屹 : 您在临床上常见肿瘤合并心脏病的患者吗?
刘鹏教授: 是的,很常见。在我们的日常临床工作中,很多肿瘤患者在描述病史时,都会提到自己既往有多年的心脏病。还有一些患者,在罹患肿瘤之前,并未合并心脏病;但是得了肿瘤之后,很多病就跟随而来了。
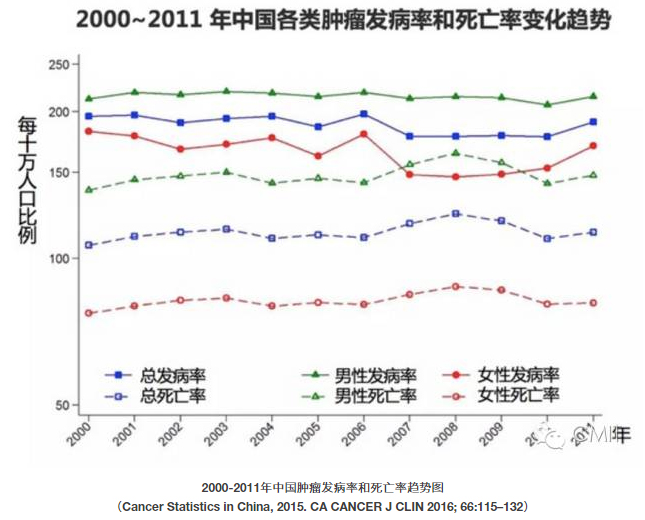
从流行病学角度来分析,2015年全国肿瘤发病率调查研究报告显示,我国癌症新发病例数及死亡人数分别达到了429.2万例和281.4万例。
以北京市举例,现在北京市居民的平均寿命已经达到了82岁。可以说,我们从发展中国家快速转变成为了老龄化国家。而就是在这二三十年,形成了如此之高的肿瘤发病态势。这让我想起英国医学会说过的一句话——在我们每个人的一生中,有一半的概率,会罹患肿瘤。
同样,伴随着人均寿命的增长,心脏病发生率也居高不下。心脏与肿瘤的发病趋势图基本上可以说是一致的。对于合并冠心病的肿瘤患者,接受化疗的风险要高于一般肿瘤患者。另一方面,化疗后患者,即使肿瘤被治愈,他们罹患心血管疾病的风险也高于一般人群,心脏事件发生率高出15倍,确诊的心血管疾病发生率要高出10倍。
所以说,肿瘤和心血管疾病这种相互交织的局面,可谓是,“你中有我,我中有你”了。
刘屹:肿瘤和冠心病的共同危险因素都有哪些,如何管理?
刘鹏教授:在这个问题上,我想强调两点。第一点是健康的生活方式。比如说,保持良好心态和饮食习惯,减少不必要的工作压力,适当放松,对心血管疾病的预防大有裨益。同时,某些肿瘤的发生率也可能会随之降低。而改变吸烟与酗酒的习惯,对减少某些特定肿瘤的发生有很大的帮助。
我们看到,美国的肺癌发生率已经下降了,这一结果主要归功于吸烟率的下降。但是,在我们国家,烟草的控制还是一项十分艰巨的工作。
此外,定期的健康体检十分重要。很多患者就是在常规体检中,及早检出了肿瘤,得到了及时预防。对于预防心血管疾病,也是如此。这就是我们一直在强调的“早发现、早诊断、早治疗”。
我自己是一个高血压患者,就是在常规体检中发现的血压升高,并没有症状。经过规律的药物治疗,现在已经将血压控制在了一个比较理想的水平。当然,我还要加强体育锻炼。
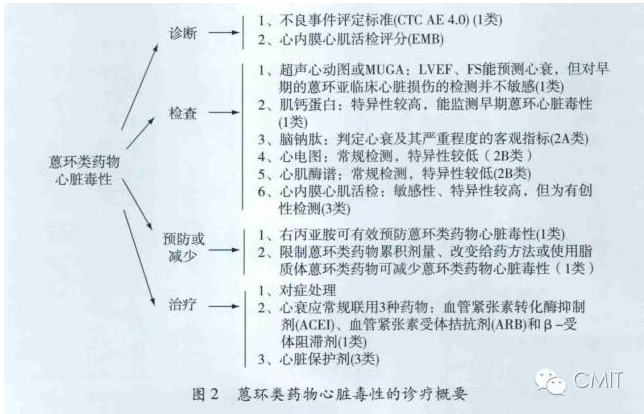
刘屹:在今年的《2016年欧洲心血管疾病预防临床实践指南》中,专门写有“肿瘤”一节。其中提到,化疗或放疗后幸存的癌症患者,心血管疾病风险增加。并且,心血管疾病的发生概率,与采用何种治疗和使用剂量相关。早些时候,在2013年,中国临床肿瘤学会(CSCO)和中华医学会血液学分会(CMA)发布了《蒽环类药物心脏毒性防治指南》。请问刘教授,化疗药物与分子靶向药物为什么会导致心脏毒性的发生?各类药物的潜在心脏毒性作用是否有所不同?如何预防?
刘鹏教授:我们一直在提到的一点是,蒽环类抗肿瘤药物具有明显的心脏毒性。究其原因,是因为这类药物可以与Fe3+结合,在心肌细胞内攻击线粒体膜,导致线粒体损伤,造成心肌损伤。
其他一些抗肿瘤药物对心肌的潜在损伤,是否也有着类似的作用机制,目前还不是十分明确。但是,可以肯定的是,在一些药品上市后临床研究中,我们看到了抗肿瘤药物治疗可能相关、或一定相关的心脏不良事件。其中一类药物是常规的化疗药物,比如紫杉醇、氟尿嘧啶。
另一类药物是靶向治疗药物。在2015年的时候,美国总统奥巴马提出了“精准医疗”的概念。其精髓,一是精准诊断,二是个体化治疗。靶向治疗药物就是基于靶点的精准治疗。但是,这不代表,靶向药物是完全安全的。
比如说,针对乳腺癌HER2靶点的常用化疗药物赫赛汀,如果与蒽环类药物联用,心脏毒性发生率是要翻倍的。治疗慢性粒细胞白血病的靶向药物伊马替尼、多靶点抗肿瘤新药索拉非尼、EGFR-TKI靶向治疗药物,也都有1%-6%、7%不等的不良心脏事件发生率。
目前,我们还不能肯定上述心脏不良事件的发生,一定是药物本身引起的。但是,这些心脏不良事件与抗肿瘤药物的应用,是存在相关性的。
既然抗肿瘤药物存在可能的心脏毒性,那么,还要考虑继续应用这类药物吗?我想我们可以从以下几方面进行考虑。
首先,在治疗前应充分评估抗抗肿瘤药物的心脏毒性风险。如果一类抗肿瘤药物对心脏的毒性作用,已经足以掩盖掉它为患者带来的生存获益,那么我们就应该及时作出相应的调整,尽可能地减少毒性作用。
拿蒽环类药物举例,我们可以通过以下4个方面,减少可能的心脏毒性发生。
第一,选用相对低毒的药物,比如表阿霉素、吡喃阿霉素、脂质体阿霉素等;
第二,酌情适当调整给药方式。以前我们对乳腺癌、淋巴瘤患者予以蒽环类药物治疗时,会采用静脉快速推注的方式,也就是我们常说的bonus给药。这种方式可以增加药物瞬时药物浓度,但是却增加了急性期心肌损伤发生率。那么现在,有研究显示,96小时持续静滴给药方案可以减少心脏毒性的发生,但是骨髓移植毒性可能有所增加。因此,我们需要对治疗方案进行均衡的通盘考虑。
第三,改变药物在体内的代谢过程。比如刚才我们提到的脂质体阿霉素,它是在阿霉素表面包裹了聚乙二醇修饰的脂质双分子层,进入人体后,经肝代谢的速度明显减慢,对心脏的毒性明显减弱了。
第四,采用有效药物预防蒽环类药物相关心脏毒性的发生。《蒽环类药物心脏毒性防治指南》提到了右丙亚胺。这类药物是螯合剂EDTA的类似物,可以与游离态铁离子螯合,而且可以从Fe3+蒽环类螯合物中夺取Fe3+,从而抑制Fe3+蒽环类螯合物诱导自由基产生,进而抑制蒽环类药物的心脏毒性。虽然,这类药物目前的价格还比较昂贵,也有一些胃肠道的不良反应。但是,我们对于某些抗肿瘤药物导致的心脏毒性,已经有了比较好的预防方法。
刘屹:以上我们谈论的是蒽环类药物心脏毒性的防治。同时,我们也希望,心脏毒性能够被早期发现。如何检测抗肿瘤药物的心脏毒性?
刘鹏教授:首先需要提到的是,超声心动图测量的左心室射血分数(LVEF)可被用于评估和监测抗肿瘤药物的心脏毒性。
如果LVEF较基线值有明显的下降,一定要警惕抗肿瘤治疗引起的心脏毒性。具体标准是:LVEF较基线值降低至少5%,且LVEF绝对值<55%,伴有心力衰竭症状或体征;或LVEF较基线值降低至少10%,且LVEF绝对值<55%,不伴有心力衰竭的症状或体征。
此外,一些生物标记物,如心肌肌钙蛋白T ( cTnT) 也可用作心脏毒性的生化检测指标。如果cTnT水平较治疗前明显升高,也应警惕抗肿瘤治疗的心脏毒性。一旦确诊抗肿瘤药物引起了心脏毒性,目前还缺乏理想的治疗方法,可供选择的治疗药物包括右丙亚胺和能量合剂。

刘屹:蒽环类药物的心脏毒性可有哪些临床表现?
刘鹏教授:患者可出现急性冠脉综合征的类似表现,或有心律失常、心衰表现,需要临床医生加以重视。
刘屹:您在临床上遇到过这类患者吗?请您与我们分享一下您的诊治体会。
刘鹏教授:有一位患者,既往有5年淋巴瘤病史,在常规化疗之后,接受了8个周期的蒽环类药物治疗,实现了病理完全缓解。此次患者因再次罹患另一类肿瘤入院。超声心动图检查LVEF是正常的,可能发生迟发性心脏毒性的蒽环类累积剂量也没有超过规定的下限。因此,考虑到既往蒽环类药物对患者治疗有效,此次我们继续予以了蒽环类药物进行抗肿瘤治疗。
但是,在治疗第2周期的时候,患者出现了心衰表现。我们停用了蒽环类药物,采用了其他抗肿瘤药物药物替换。同时联合心内科对心衰进行了治疗,并对未来可能出现的心脏毒性反应,采用了相应的预防措施。
目前,该患者病情控制良好,生存期得以延长,没有心功能恶化表现。我们建议患者定期心内科复查。
刘屹: 放疗对心脏的可能损伤程度有多大?特别是乳腺癌的放疗,放射性胸腔脏器损伤多见吗?
刘鹏教授:虽然乳腺癌患者需要接受胸壁电子束照射,但是心脏事件发生几率,要比淋巴瘤、特别是纵隔淋巴瘤患者来得低。因为乳腺癌的放疗仅涉及浅层照射,不会涉及到心脏和大血管。而针对原发纵隔淋巴瘤、或者小细胞肺癌的放疗,射线会到达胸腔,容易损伤心脏,出现心脏不良事件。这其中,可能的原因一方面是由于放疗对微血管的内皮细胞造成了损伤,当然也不排除对大血管可能造成的损伤。另一方面,因为射线本身会覆盖到一部分心脏,可能诱发瓣膜病变、心肌病或动脉粥样硬化程度加剧。
为预防可能的心脏不良事件发生,现在我们在放疗过程中会采用一些新兴的技术。比方说,三维适型调强这种技术。我们设“门”的时候,会尽可能地精准定位,把靶区与正常组织区分开来,以减少放疗的副总用。
还有一些简单、易行的小窍门,比如嘱患者在放疗时适当深吸气憋住,也可起到一定的预防作用。
此外,我们可能还会用到一些预防性治疗和密切监测手段。
刘屹: 肿瘤容易合并高凝状态,或存在出血风险。那么,对于合并有肿瘤的冠心病患者,如何选择介入治疗策略?围手术期又该如何进行抗凝治疗?
刘鹏教授:如果是实体肿瘤患者,血小板通常不会降低,患者接受心脏介入治疗的风险不是很大。即使是在抗肿瘤治疗之后,血小板低于5万/mm3的情况也并不多见,对心脏支架治疗不会造成太大的影响。
如果是血液肿瘤患者,比如白血病、四期淋巴瘤等造成骨髓侵犯十分严重者,或者是多发性骨髓瘤,血小板已经明显降低的患者。建议心脏科与肿瘤科医生根据患者的一般状况、病情需要和血小板计数,联合进行治疗决策。
我曾遇到一例这样的患者,以“胸闷、憋气”就诊于心血管专科医院。医生考虑为急性心梗,需要进行支架置入治疗。但是,术前胸片检查发现了纵隔占位性病变,确诊为小细胞肺癌。
考虑到患者此次发病,可能与肿瘤导致的凝血系统功能异常有关。面临的问题是,现在是该先治心脏病?还是先治肿瘤?
首先,如果这例患者不能很快接受心脏干预的话,是无法耐受正规的抗肿瘤治疗的。其次,小细胞肺癌进展迅速,肿瘤科医生不可能等到心脏术后1个月,再对肿瘤进行干预。到那时,可能一切都无法挽回。
最终,经过肿瘤科与心脏科的多学科协作(MDT)治疗模式,决定在充分抗凝基础上,先行心脏介入手术。术后7天,我们给予患者口服小剂量化疗药物,以抑制肿瘤进展。当满足心脏术后抗凝需求,并且凝血系统监测指标在正常范围之内后,我们予以了患者接近指南推荐意见的抗肿瘤方案。最终,患者预后良好。
刘屹:肿瘤学科和心血管学科都在迅猛发展,所以,这两个单一学科的医生很难掌握对方学科的治疗进步。但是有着太多的复杂临床问题,需要解决。2016年6月5日,全国十余家三甲医院,包括心血管、肿瘤学、血液学、肿瘤放疗、影像学领域的17名专家学者,召开了全国第一次肿瘤心脏病学研讨会。对此您有何观点?
刘鹏教授:老龄化社会带来了不少问题,我们看到肿瘤合并心脏病、代谢性疾病等其他疾病的情况越来越多见。成立各类MDT诊疗组,可以为患者提供更为综合、全面的诊疗策略。相信随着临床医生对交叉学科的更多了解,在将来会为患者创造出更多、更好的治疗模式。
刘屹:非常感谢您的观点分享。
CopyRight © 2017 北京新元鹏泰医疗科技有限公司 版权所有 京ICP备16025967号-1 京公网安备11010102001423号

